トップページ > ニュース・トピックス > プレスリリース > 糖尿病・脂肪性肝炎の新たな発症機序の解明
糖尿病・脂肪性肝炎の新たな発症機序の解明
2019年2月27日
国立国際医療研究センター
発表のポイント
- 肝臓では、食事のたびに小胞体ストレスが誘導され、インスリンの作用が正常であれば、食事で発現が誘導されるSdf2l1という分子が小胞体ストレスを適切に終息させていることを見いだしました。
- 糖尿病の場合は、Sdf2l1の発現誘導がうまくいかず、糖尿病を悪化させるという悪循環をもたらすうえに、現在世界中で肝臓がんの原因として重要となってきている脂肪性肝炎の発症メカニズムに関わることを明らかにしました。
- 今回着目したSdf2l1という分子やその発現量が、糖尿病や脂肪性肝炎の治療標的やバイオマーカーとなることが期待されます。
発表者
- 笹子 敬洋(国立国際医療研究センター研究所 糖尿病研究センター研究員、東京大学大学院医学系研究科 分子糖尿病科学講座 特任助教)
- 門脇 孝(東京大学大学院医学系研究科 糖尿病・生活習慣病予防講座 特任教授)
- 植木 浩二郎(国立国際医療研究センター研究所 糖尿病研究センター センター長)
発表概要
肝臓での代謝は絶食時と摂食時で大きく変化しますが、その生理的意義や調節機構、またその破綻がいかに種々の疾患の病態形成に寄与するかについては、これまで十分解明されていませんでした。このたび東京大学大学院医学系研究科分子糖尿病科学講座 特任助教 笹子敬洋、同糖尿病・生活習慣病予防講座 特任教授 門脇孝、国立国際医療研究センター研究所糖尿病研究センター センター長 植木浩二郎らのグループは、絶食・摂食で大きく変化する肝臓での小胞体ストレス※1とそれに対する応答に注目し、Sdf2l1※2という分子の果たす役割を明らかにしました。
まずマウスでの実験から、摂食によって肝臓で小胞体ストレスが一時的に惹起されることを見出しました。また、複数の小胞体ストレス関連遺伝子の中でも特にSdf2l1という遺伝子の発現が大きく上昇していました。Sdf2l1は小胞体ストレスに応答して転写レベルで誘導を受けますが、その発現を低下させると小胞体ストレスが過剰となり、インスリンの効きが悪くなるインスリン抵抗性※3や脂肪肝が生じました。また肥満・糖尿病のモデルマウスではSdf2l1の発現誘導が低下していましたが、発現を補充するとインスリン抵抗性や脂肪肝が改善しました。加えてヒトの糖尿病症例の肝臓において、Sdf2l1の発現誘導がインスリン抵抗性や脂肪性肝炎の病期の進行と相関することが示されました。
このことから、摂食に伴う小胞体ストレスに対する適切な応答が重要であると共に、その応答不全が糖尿病・脂肪性肝炎の原因となることが示されました。今後は、Sdf2l1やその発現量が、糖尿病・脂肪性肝炎の治療標的やバイオマーカーとなることが期待されます。
発表内容
研究背景
肝臓は全身の代謝を考える上でも鍵を握る重要な臓器です。その代謝は絶食時と摂食時で大きく変化することが知られる一方、その調節機構が破綻することで、肥満に伴う糖尿病や脂肪肝といった疾患の原因になるものと考えられてきました。しかし摂食時に肝臓で起こる変化の詳細や、その破綻がどのように疾患に至るのかについては、これまで十分に解明されていませんでした。
研究内容
このような背景を踏まえ、研究グループではまず、マウスの肝臓におけるマイクロアレイ解析の結果を分析し、絶食時と摂食時での遺伝子発現変化を網羅的に比較しました。その結果、摂食時に複数の小胞体ストレス関連遺伝子の発現が上昇しており、中でもSdf2l1という遺伝子の発現が大きく上昇していました。
これまで慢性の小胞体ストレスは、疾患の原因になるものと考えられてきました。実際にマウスの肝臓では、小胞体ストレス下で誘導や活性化を受けるマーカー遺伝子・タンパクの発現やリン酸化が、摂食によって一時的に上昇していました。すなわち食事という刺激によって、生理的な小胞体ストレスが一過性に惹起されるものと考えられました。 Sdf2l1の発現も摂食時に上昇していました。培養細胞系も含めた解析から、Sdf2l1は小胞体ストレスで活性化する転写因子XBP-1sとATF6※4によって、転写レベルで発現誘導を受けることが分かりました。続いて機能を考える上で、研究グループは小胞体ストレス関連タンパク分解ERAD※5に着目し、Sdf2l1の発現が低下すると、本来分解されるべき変異タンパクが蓄積することを見出しました。さらに質量分析の手法によって、Sdf2l1と相互作用を示すタンパクを網羅的に検索し、膜輸送関連タンパクTMED10※6を同定しました。Sdf2l1がTMED10と相互作用をしながら、協調的にERADの調節を介して、小胞体ストレスを収束させることを見出しました。
このように小胞体ストレスに対して保護的に作用するSdf2l1の発現を、マウスの肝臓で低下させると、特に摂食時の小胞体ストレスが亢進し、インスリン抵抗性、耐糖能の増悪、中性脂肪含量の増加を来たすことが分かりました。すなわちSdf2l1は摂食に伴う小胞体ストレスを収束させることで、糖脂質代謝の調節も担うことが明らかとなりました。
肥満・糖尿病のモデルマウスにおいては、小胞体ストレスセンサーが活性化している一方、それに応答すべき転写因子、中でもXBP-1sの核移行が低下していました。本研究グループによる研究を含めた先行研究により、XBP-1sはインスリンシグナルによって核に移行して活性を示すことが報告されており、このモデルマウスで見られた核移行の低下は、インスリン作用の低下を反映したものと考えられました。XBP-1sの転写活性を調べるとやはり低下しており、その結果下流で小胞体ストレスを収束させる分子、中でもSdf2l1の発現が大きく低下していました。このマウスにSdf2l1の発現を補充すると、摂食時の小胞体ストレスが軽減され、インスリン抵抗性、耐糖能、脂肪肝がいずれも改善しました。
最後にこのような小胞体ストレス応答の低下が、ヒトの病態形成に及ぼす影響を明らかにするため、東京大学医学部附属病院 消化器内科との共同研究で、肝生検※7検体における遺伝子発現を解析しました。肝臓でのインスリン抵抗性のある症例では、上流のXBP1-sと比較して下流のSdf2l1の発現が相対的に低下しており、小胞体ストレスに対する応答が低下しているものと考えられました。また脂肪性肝炎の病期(線維化)も、上流のXBP1-sと比較して下流のSdf2l1の発現が相対的に低いほど進行しました。このような相関はいずれも糖尿病合併症例でのみ認められました。すなわちインスリン抵抗性があっても、糖尿病がなければインスリン分泌増加によって埋合せがなされますが、糖尿病を発症している場合は埋合せがうまくいかずに肝臓でのインスリン作用が不足します。すると小胞体ストレス応答が減弱してSdf2l1が誘導されず、脂肪性肝炎の進行の原因となる可能性が考えられました。
以上をまとめますと、摂食に伴い生理的・一過性の小胞体ストレスが肝臓で惹起されますが、これに対する適切な応答が重要であり、Sdf2l1がその応答の鍵分子となることが明らかとなりました。一方で小胞体ストレスへの応答不全が、ヒトにおいても糖尿病・脂肪性肝炎の原因となることが示されました。
社会的意義
これまで脂肪性肝炎の発症機序は十分明らかとはなっていませんでしたが、糖尿病に合併した脂肪性肝炎については、小胞体ストレスに対する応答不全の寄与があることが明らかとなりました。またSdf2l1はその応答における鍵分子の候補であり、ヒトの糖尿病・脂肪性肝炎の治療標的となること、ならびにその発現量が良いバイオマーカーとなることが期待されます。
添付資料
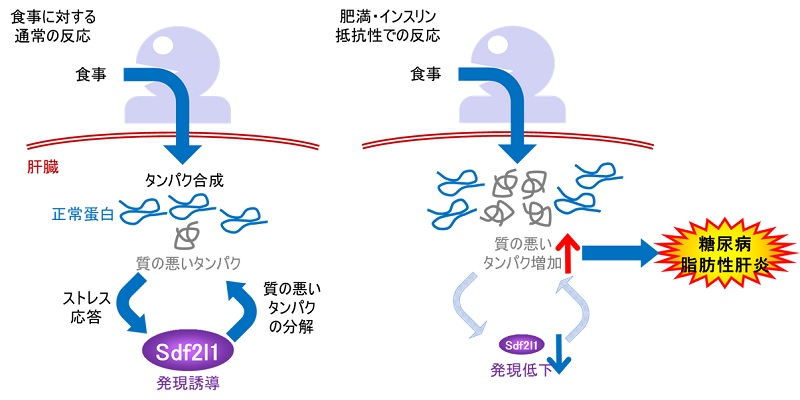
食事の際に肝臓ではタンパクの合成が増加し、質の悪いタンパク(変異タンパク)も増えますが、これに対応するためにSdf2l1という分子が誘導され、質の悪いタンパクを分解する働きを果たします。一方で肥満・インスリン抵抗性ではSdf2l1の量が低下しており、そのために質の悪いタンパクが増加し、糖尿病や脂肪性肝炎の原因となることが明らかとなりました。
用語解説
- 小胞体ストレス: 小胞体は分泌タンパクや膜タンパクが合成される細胞内小器官である。小胞体の中でタンパクは折り畳みなどを受けて正しい機能を持つ成熟タンパクとなるが、小胞体の機能低下などが原因で、本来の折り畳みを受けない異常タンパク(変異タンパク)が小胞体内に蓄積した状態を、小胞体ストレスと呼ぶ。
- Sdf2l1: stromal cell-derived factor 2 like 1の略。これまで小胞体ストレスによって発現が増加することや、小胞体の中でタンパクの折り畳みなどを行なうシャペロン複合体を形成することが報告されていたが、詳しい機能や糖脂質代謝に及ぼす影響は知られていなかった。
- インスリン、インスリン抵抗性:インスリンは膵臓のβ細胞という細胞から分泌されるホルモンで、血糖を下げるなどの作用を持つ。肥満などの病態では、血液中のインスリン濃度が保たれているにも拘らずインスリンの効きが低下することが知られており、これをインスリン抵抗性と呼ぶ。
- XBP-1s、ATF6: いずれも転写因子であり、それぞれspliced X-box binding protein 1、 activating transcription factor 6の略。小胞体ストレスに対する防御機構の一環として、これらの転写因子が活性化し、シャペロン分子などの発現が誘導される。このうちXBP-1sは肝臓において、インスリンシグナルによって核へ移行し、転写因子としての活性を発揮することを、本研究グループが以前に報告していた。
- ERAD: endoplasmic reticulum-associated degradationの略。小胞体ストレスに対する防御機構の1つで、小胞体内の異常タンパク(変異タンパク)をプロテアソームという細胞内小器官に輸送し、分解する仕組み。
- TMED10: transmembrane emp24-like trafficking protein 10の略。膜上に存在する輸送タンパクで、哺乳類ではタンパクの小胞体からゴルジ体への輸送に関与することが報告されてきた。酵母においては、Sdf2l1のオルソログであるPmt1/2と、TMED10のオルソログであるp24とが結合し、ERADを促進することが知られていた。
- 肝生検: 体の外から針を刺して、肝臓の組織の一部を採取すること。通常はその一部を薄く切って染色し、肝臓の病気の正確な診断に役立てる。本研究では倫理委員会の承認、並びに患者さんの同意を得て、採取された組織の一部からRNAを抽出し、遺伝子発現を解析した。
発表雑誌
- 雑誌名:Nature Communications
- 論文タイトル:Hepatic Sdf2l1 controls feeding-induced ER stress and regulates metabolism
- 著者:Takayoshi Sasako *, Mitsuru Ohsugi, Naoto Kubota, Shinsuke Itoh, Yukiko Okazaki, Ai Terai, Tetsuya Kubota, Satoshi Yamashita, Kunio Nakatsukasa, Takumi Kamura, Kaito Iwayama, Kumpei Tokuyama, Hiroshi Kiyonari, Yasuhide Furuta, Junji Shibahara, Masashi Fukayama, Kenichiro Enooku, Kazuya Okushin, Takeya Tsutsumi, Ryosuke Tateishi, Kazuyuki Tobe, Hiroshi Asahara, Kazuhiko Koike, Takashi Kadowaki *, and Kohjiro Ueki *.
- DOI番号:10.1038/s41467-019-08591-6
本件に関するお問合わせ先
東京大学大学院医学系研究科 糖尿病・生活習慣病予防講座
特任教授 門脇 孝(かどわき たかし)
電話: 03-5800-8815(直通)
FAX: 03-5800-9797
E-mail:kadowaki-3im@h.u-tokyo.ac.jp
国立国際医療研究センター研究所 糖尿病研究センター
センター長 植木 浩二郎(うえき こうじろう)
電話: 03-3202-7181(内線2876)
FAX: 03-3207-7364
E-mail:uekik@ri.ncgm.go.jp
取材に関するお問合せ先
国立健康危機管理研究機構 危機管理・運営局 広報管理部
電話:03-3202-7181(代表) <9:00~17:00>
E-mail:press [ a ] jihs.go.jp
※ [ a ]を@にしてご送信ください。